苏州纳米所黄洁副研究员等CEJ:生物3D打印构建乳腺癌-血管-骨共培养模型用于体外研究乳腺癌骨转移和药物敏感性
发布日期:2023-11-16 浏览次数: 【大中小】 【关闭】
乳腺癌骨转移是晚期乳腺癌最常见的并发症之一,乳腺癌骨转移后常伴随着骨疼痛、脊神经压迫和病理性骨折等并发症,进一步加重患者的病情,但是传统的2D细胞模型和实验动物模型都难以真实模拟乳腺癌细胞通过血管转移至骨的全过程,导致临床前药物筛选的准确率较低。
近期,中国科学院苏州纳米所黄洁副研究员等为了模拟和深入考察原发肿瘤通过血管到达骨微环境的动态转移过程,采用“一步法”生物3D打印技术构建了由肿瘤、中空血管和骨组织组成的三维仿生共培养转移模型,并且将其应用于抗肿瘤药物的药效测试评估(图1)。
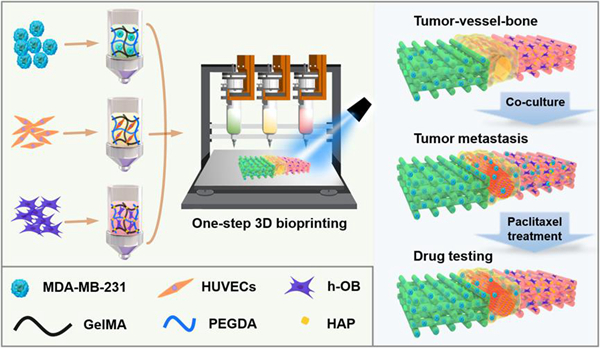
图1. “一步法”生物3D打印构建乳腺癌-血管-骨转移模型
科研人员利用甲基丙烯酰基明胶分别和乳腺癌细胞(MDA-MB-231)、人脐静脉内皮细胞(HUVECs)和成骨细胞(h-OB)混合后进行载细胞生物3D打印构建了乳腺癌-血管-骨共培养模型。该共培养模型高度模拟了原生肿瘤的转移微环境;在中空血管结构的管腔中形成了致密的血管网络并且血管网络能够延伸至相邻的肿瘤和骨组织中,重现了血管化组织的形成过程(图2);再现了乳腺癌细胞从原发部位通过血管向骨组织的动态侵袭行为(图3)。此外,血管化共培养模型能够进一步促进肿瘤细胞的增殖、转移和异位定植。与2D细胞模型和3D单细胞培养模型相比,3D共培养模型中的乳腺癌细胞对抗癌药物的耐药性更高,并能有效反映抗癌药物对肿瘤细胞增殖和转移的抑制作用。因此,该工作所构建的生物3D打印共培养转移模型有助于深入了解乳腺癌迁移的过程和机理,这为药物临床前研究提供了一个更加模拟体内乳腺癌转移微环境的药筛平台。
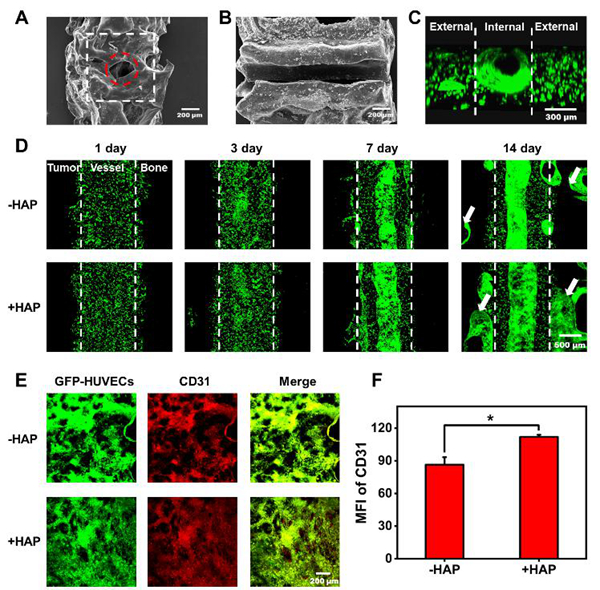
图2. 乳腺癌-血管-骨转移模型的血管化过程
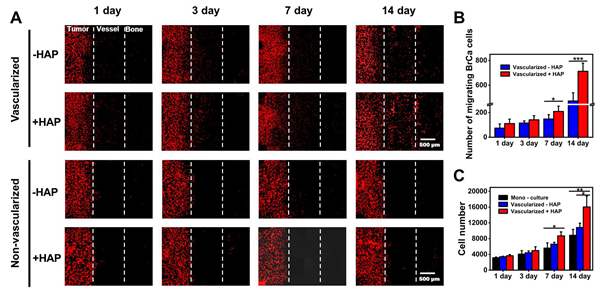
图3. 乳腺癌细胞在转移模型中的迁移行为
述研究以3D bioprinted tumor-vessel-bone co-culture scaffold for breast cancer bone metastasis modeling and drug testing为题,近期发表于国际学术期刊Chemical Engineering Journal上,中国科学院苏州纳米所类器官创新中心博士生程胜男为论文第一作者,邓宗武研究员、黄洁副研究员和张智军研究员为共同通讯作者。
 扫一扫关注我们
扫一扫关注我们
